9月18日,我校口腔医学院陈陶教授团队在国际权威期刊NatureCommunications发表了题为5-ALA photodynamic metabolite-powered zero-waste ferroptosis amplifier for enhanced hypertrophic scar therapy的最新研究成果。

增生性瘢痕(HS)是一种顽固性的皮肤纤维化疾病,常见于烧伤、外伤或术后修复阶段。当发生于口腔颌面部时,其危害尤为严重,除影响面部美观外,还可能导致张口受限、言语与咀嚼障碍等功能损害。5-氨基酮戊酸(5-ALA)介导的光动力疗法(PDT)在临床中应用广泛,虽可通过产生活性氧(ROS)清除异常成纤维细胞,但其代谢副产物往往被忽视。本研究首次提出5-ALA光动力代谢废物“再能量化”策略,通过与铁死亡(ferroptosis)过程耦合,将PDT的瞬时光化学反应转化为可持续的代谢驱动,实现长期抗瘢痕治疗。
本研究中,陈陶研究团队研究团队以5-ALA为光敏前体,经代谢生成原卟啉IX(PpIX)后触发PDT,同时控制黄芩苷(baicalin)的释放以诱导铁死亡。两者协同激活HO-1–heme代谢轴,促进Fe²⁺与CO释放,形成持续的铁死亡反馈环路。该过程不仅放大了ROS反应,还通过5-ALA代谢副产物的“再能量化”实现了零废弃治疗闭环。为实现局部、可控递药,研究人员将双药物纳米复合物(FAB NPs)封装入聚乙烯吡咯烷酮微针(MN)贴片中,构建出FAB@MN系统。体外实验显示,FAB@MN显著上调瘢痕成纤维细胞(HSFs)内的ROS、Fe²⁺与脂质过氧化(LPO)水平,诱导线粒体损伤及PINK1/Parkin介导的异常自噬,进一步放大铁死亡效应。在兔耳瘢痕模型中,仅一次光照即可产生强烈且持久的ROS信号;四周后,瘢痕表面趋于平整,颜色接近正常皮肤,疗效明显优于单药组及传统糖皮质激素治疗。超声与组织学分析证实,FAB@MN显著降低瘢痕厚度并减少胶原沉积。总体而言,该研究提出了一种基于5-ALA光动力代谢副产物再利用的零废弃铁死亡放大体系(FAB@MN),为增生性瘢痕及其他纤维化疾病的精准干预提供了新的思路与材料平台。
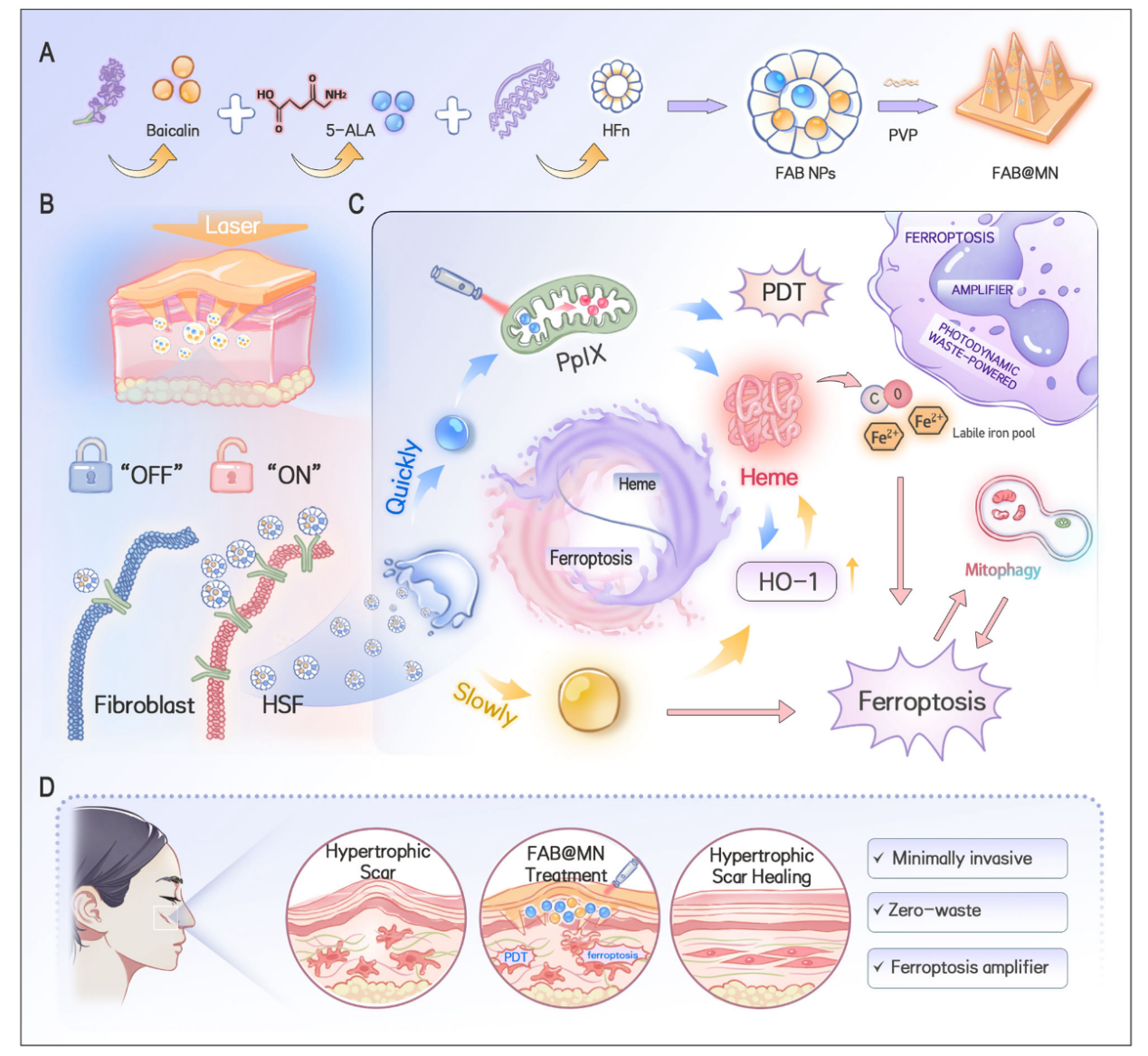
FAB@MN实现口腔颌面部增生性瘢痕治疗的整体机制示意图
陈陶教授为该论文的最后通讯作者,博士后陈媛与博士生王珊为共同第一作者。该研究得到了国家优秀青年科学基金、国家自然科学基金和重庆市杰出青年科学基金等项目的资助。
全文链接:https://doi.org/10.1038/s41467-025-63438-7