2025年11月6日,AB平台信息与肿瘤免疫研究院张泽民院士团队联合合作方在Cancer Cell期刊在线发表题为“Remodeling of T and endothelial cells during total neoadjuvant therapy in rectal cancer”的研究论文。

该研究通过多维度技术手段,系统解析全程新辅助治疗(total neoadjuvant therapy, TNT)对局部晚期直肠癌(locally advanced rectal cancer, LARC)肿瘤免疫微环境的重塑,揭示CD8+T细胞与内皮细胞的相互作用是TNT发挥临床疗效的潜在重要原因。该成果为提升结直肠癌治疗疗效、优化临床诊疗方案提供了新视角,有助于我们对结直肠癌新辅助治疗领域复杂机制的理解。
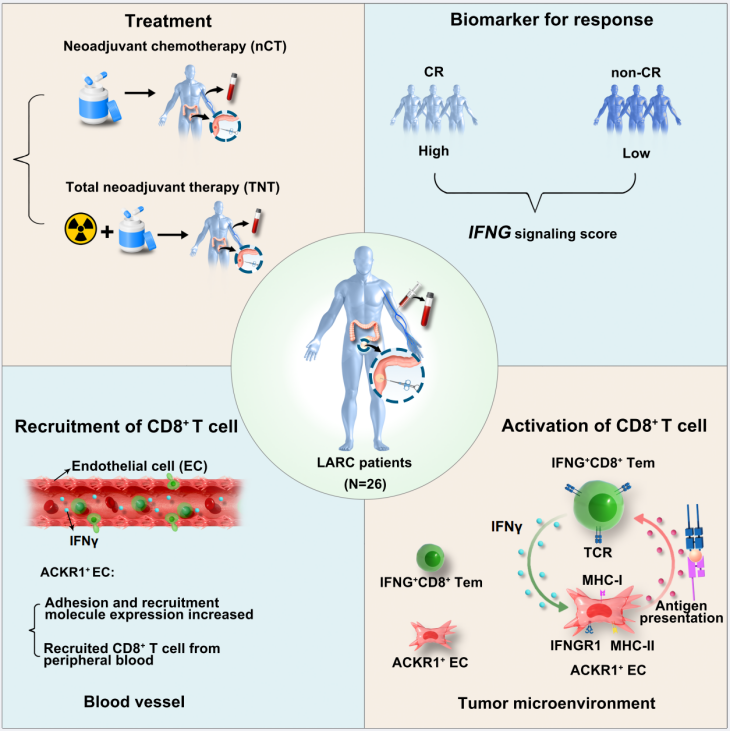
结直肠癌是全球高发的消化道恶性肿瘤,约85%的结直肠癌患者具有微卫星稳定性及成熟错配修复能力(pMMR),该类患者免疫原性弱,对免疫检查点抑制剂治疗响应差,新辅助放化疗成为推荐方案,尤其是能进一步提升患者完全响应率的TNT疗法。但TNT在单细胞层面影响免疫组分与细胞相互作用的机制尚不明确,制约着临床转化与疗效优化。
针对这一问题,研究团队对26例pMMR LARC患者治疗前后的组织及血液样本开展研究,结合单细胞测序、空间转录组测序等技术及实验验证,首次阐明CD8+T细胞与内皮细胞的相互作用可能是TNT发挥临床疗效的核心机制。
研究发现,TNT可显著提升肿瘤组织中IFNG+CD8+T细胞的浸润比例,上调肿瘤微环境中IFNG及相关信号表达,同时系统性增强外周血IFNG信号强度,且该信号强度可作为判断患者是否完全响应的潜在生物标志物。
研究还发现内皮细胞(endothelial cells, ECs)ACKR1+亚群是招募外周血CD8+T细胞进入肿瘤微环境的关键“载体”。TNT治疗后,ACKR1+ECs招募能力、抗原递呈及T细胞激活能力均提升,且对CD8+T细胞的激活具抗原特异性。同时,ACKR1+ECs的IFNG信号及IFNGR表达水平显著上升,提示其功能受IFNG+CD8+T细胞分泌的IFNγ调控,二者形成作用闭环,放大抗肿瘤免疫效应,提升肿瘤杀伤效率。
该课题起步于深圳湾实验室肿瘤研究所,最终在AB平台完成,深圳湾实验室为该课题提供了重要支持。合作单位包括深圳湾实验室、北京大学、中山大学肿瘤防治中心和基因组多维解析技术全国重点实验室等。AB平台/北京大学BIOPIC张泽民院士、中山大学肿瘤防治中心丁培荣主任、北京大学BIOPIC朱琳楠副研究员、AB平台程斯进教授及高千千教授为该文共同通讯作者;AB平台高千千教授、北京大学博士生凌心楠、中山大学肿瘤防治中心廖乐恩博士、北京大学博士后唐非、基因组多维解析技术全国重点实验室&杭州华大生命科学研究院姜宇佳博士为共同第一作者。
全文链接:https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00449-0